ARTIGO
Identificação e notificação de eventos adversos: Qual a importância e como fazer?

A matéria apresenta o conceito de eventos adversos aos medicamentos e as formas para notificá-los. Também alerta sobre a importância do farmacêutico realizar as notificações com o objetivo de melhorar a segurança do paciente.
Os eventos adversos aos medicamentos podem ter consequências graves para a saúde da população, levando ao aumento do custo operacional do sistema de saúde e do número de mortes. Portanto, notificar a ocorrência de eventos adversos aos medicamentos é uma ação importante para que as empresas que produzem os medicamentos e a ANVISA possam acompanhar a segurança dos tratamentos.1-4
O que é um evento adverso a medicamento?
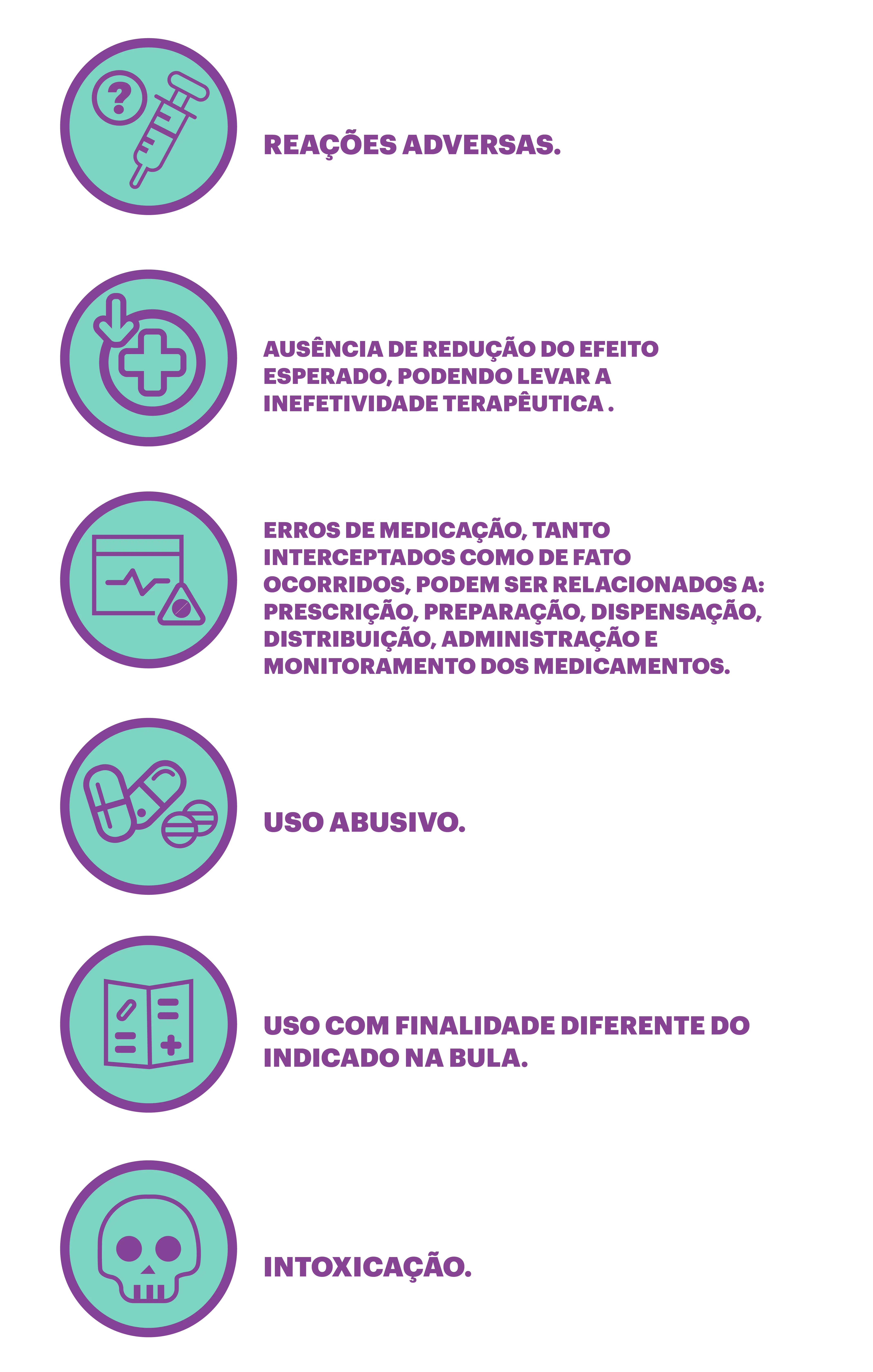
É considerado evento adverso a medicamento qualquer ocorrência médica indesejável devido ao uso de medicamentos que cause dano à saúde, tais como:3,5
A Farmacovigilância é a área da prática farmacêutica que tem como objetivo identificar, avaliar e monitorar a ocorrência dos eventos adversos relacionados ao uso dos medicamentos comercializados. Com isso, seu principal foco é garantir que os benefícios desses produtos sejam maiores que os riscos relacionados ao seu uso. O farmacêutico, por sua vez, é uma figura essencial nesse processo, visto que é detentor do conhecimento técnico e de habilidades fundamentais na identificação de eventos adversos relacionados à medicamentos, como:4,6
- possíveis reações adversas,
- suspeitas de interações medicamentosas,
- problemas por desvio de qualidade,
- detecção de possível inefetividade terapêutica,
- queixas técnicas de desvio de qualidade.
Notificação de eventos adversos no Brasil
Em 2013, foi estabelecida a obrigatoriedade de implantação do Núcleo de Segurança do Paciente (NSP), visando a segurança dos pacientes nos serviços de saúde. Adicionalmente, os detentores de registro de medicamento para uso humano (as farmacêuticas) devem seguir normas específicas que estabeleçam:4,5
- boas práticas de farmacovigilância,
- fluxo de notificações em farmacovigilância,
- requisitos, responsabilidades e padrões de trabalho (procedimentos operacionais padronizados),
- envio de relatórios periódicos de avaliação benefício-risco.
Para as farmácias e drogarias, com base na Lei nº 13.021/14, obriga-se o farmacêutico, no exercício de suas atividades, a notificar os profissionais de saúde e os órgãos sanitários competentes, bem como o laboratório industrial, quando observados os seguintes eventos relacionadas a medicamentos:4
- efeitos colaterais;
- reações adversas;
- intoxicações, voluntárias ou não;
- farmacodependência.

Para deixar mais claro o que são queixas técnicas relacionadas a produtos de saúde e medicamentos, vamos listar aqui alguns exemplos relatados em um hospital sentinela no interior do estado de São Paulo:10
- vazamento;
- aspecto diferente do habitual (como a cor, solução precipitada, presença de corpo estranho);
- dificuldade de abertura do frasco;
- comprimidos quebrados;
- frasco ou blister sem a medicação;
- rótulo ausente ou de difícil identificação;
- problemas com a embalagem, como: ampola quebrada dentro da caixa lacrada, lacre com defeito, tampa quebrada, frasco muito frágil ou furado.
Neste mesmo estudo, foi identificado que o setor do hospital que mais notificou foi a Farmácia (26% das notificações), como mostrado na Figura 1.10
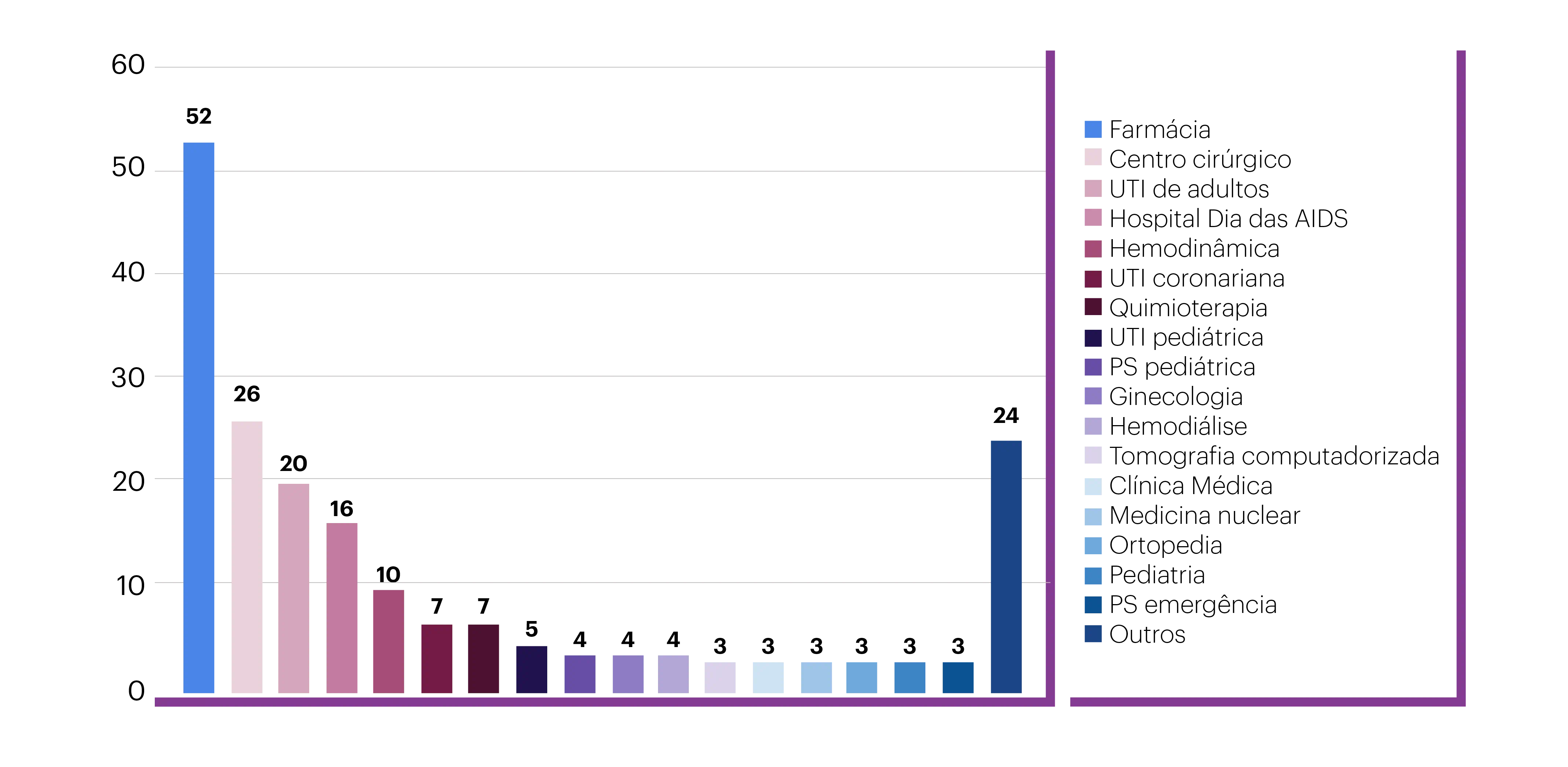
Figura 1. Distribuição do número de notificações para a farmacovigilância, segundo setor que relatou a ocorrência, de hospital no interior do estado de São Paulo entre 2009 e 2010. (Adaptado de: Lima et al. Epidemiol. Serv. Saúde, 2013:22(4), 679-686.)10
Qual a importância em se notificar eventos adversos?
As notificações fornecem ao Sistema Nacional de Vigilância Sanitária (SNVS) informações sobre reações adversas ou efeitos não-desejados dos medicamentos, além de demais produtos de interesse à saúde. Com isso, busca-se aperfeiçoar o conhecimento sobre os efeitos dos mesmos e, quando indicado, alterar recomendações sobre seu uso e cuidados. Além disso, com esses dados, é possível promover ações de proteção à saúde pública por meio da regulação adequada dos medicamentos comercializados no país.4
Um exemplo da atuação da farmacovigilância ocorre no acompanhamento de novos produtos. Ao ganhar o mercado, um medicamento acaba sendo utilizado por um número muito maior de pessoas do que o número de participantes dos estudos clínicos. Assim, muitos efeitos que até então não haviam sido observados/relatados, começam a se manifestar nos usuários. Desse modo, é de suma importância a realização das notificações de eventos adversos de medicamentos pelo farmacêutico, pois com isso a ANVISA monitora se, na vida real, os benefícios observados nos estudos prévios continuam superando os riscos decorrentes de sua utilização.4
Nem toda notificação gera uma medida sanitária imediata. Muitas vezes é necessário um conjunto de notificações para que as informações geradas sejam consistentes a ponto de desencadear ações por parte do SNVS. Por isso é importante notificar sempre que houver suspeita de evento adverso ou queixa técnica.4
Desta forma, o sistema de farmacovigilância procura identificar possíveis problemas relacionados ao uso de medicamentos de forma efetiva e oportuna, a fim de prevenir ou minimizar eventuais danos à saúde dos indivíduos.4

Como notificar os eventos adversos?
É importante que os profissionais da saúde realizem as notificações de eventos adversos junto aos órgãos sanitários por meio do VigiMed ou do Sistema De Notificações em Vigilância Sanitária (Notivisa), descritos abaixo. Também é importante notificar a empresa detentora do registro do medicamento (farmacêutica que comercializa a medicação no Brasil).4
VigiMed
É o novo sistema de notificação de eventos adversos relacionados a medicamentos e vacinas, disponibilizado pela Anvisa. As notificações podem ser feitas mediante acesso fácil e rápido, sem necessidade de cadastro, por meio do formulário eletrônico, por:4
- cidadãos;
- profissionais liberais (aqueles não vinculados a nenhuma instituição);
- profissionais dos Serviços de Saúde e Vigilâncias Sanitárias (por meio de cadastro simplificado para acesso ao sistema).
No caso de problemas ou eventos adversos com o uso do medicamento, é importante notificar principalmente os eventos considerados graves, além de reações não descritas na bula do produto.Para isso,não é necessário ter certeza de que o medicamento é a causa da reação,a suspeita é suficiente.3
Entre as vantagens deste novo sistema está a disponibilização de funcionalidades mais modernas para avaliação das notificações pela farmacovigilância, com geração facilitada de informações para tomada de decisão e para divulgação ao público externo.4
O VigiMed substitui o Notivisa somente nos casos de eventos adversos relacionados ao uso de medicamentos e vacinas. Para eventos adversos de outras classes de produtos e serviços sob vigilância sanitária, e/ou queixas técnicas sobre estes, inclusive de medicamentos e vacinas, continuará sendo utilizado o Notivisa.3
Link para acesso ao VigiMed:http://antigo.anvisa.gov.br/vigimed/saiba-mais
Notivisa
O Notivisa é um outro sistema informatizado desenvolvido pela Anvisa para receber notificações de incidentes, eventos adversos e queixas técnicas relacionadas ao uso de produtos (cosméticos, produtos para saúde, saneantes) sob vigilância sanitária. Este Sistema Nacional de Notificações para a Vigilância Sanitária pode ser usado por todos, mas com algumas diferenças:4
- Profissionais vinculados à empresa/instituição de saúde: é necessário um cadastro prévio da instituição/empresa de saúde na qual encontra-se vinculado e posterior cadastro do profissional, com associação do perfil de acesso como notificador.
- Profissional que não mantém vínculo com nenhuma instituição/empresa de saúde: a notificação se faz por meio do prévio cadastro como profissional de saúde liberal.
- Para o cidadão: não é necessário ter um cadastro prévio, basta acessar os formulários de notificação.
Ressalta-se que também devem ser notificadas ao Notivisa:4
- as queixas técnicas de medicamentos quando não houve dano ao paciente/não relacionadas a eventos adversos, ou seja, as suspeitas de alterações em produtos ou irregularidades de empresas;
- as notificações por empresas detentoras de registro de medicamentos.
Link para acesso e cadastro Notivisa: http://antigo.anvisa.gov.br/notivisa
Entenda as principais diferenças entre o Notivisa e o Vigimed:3
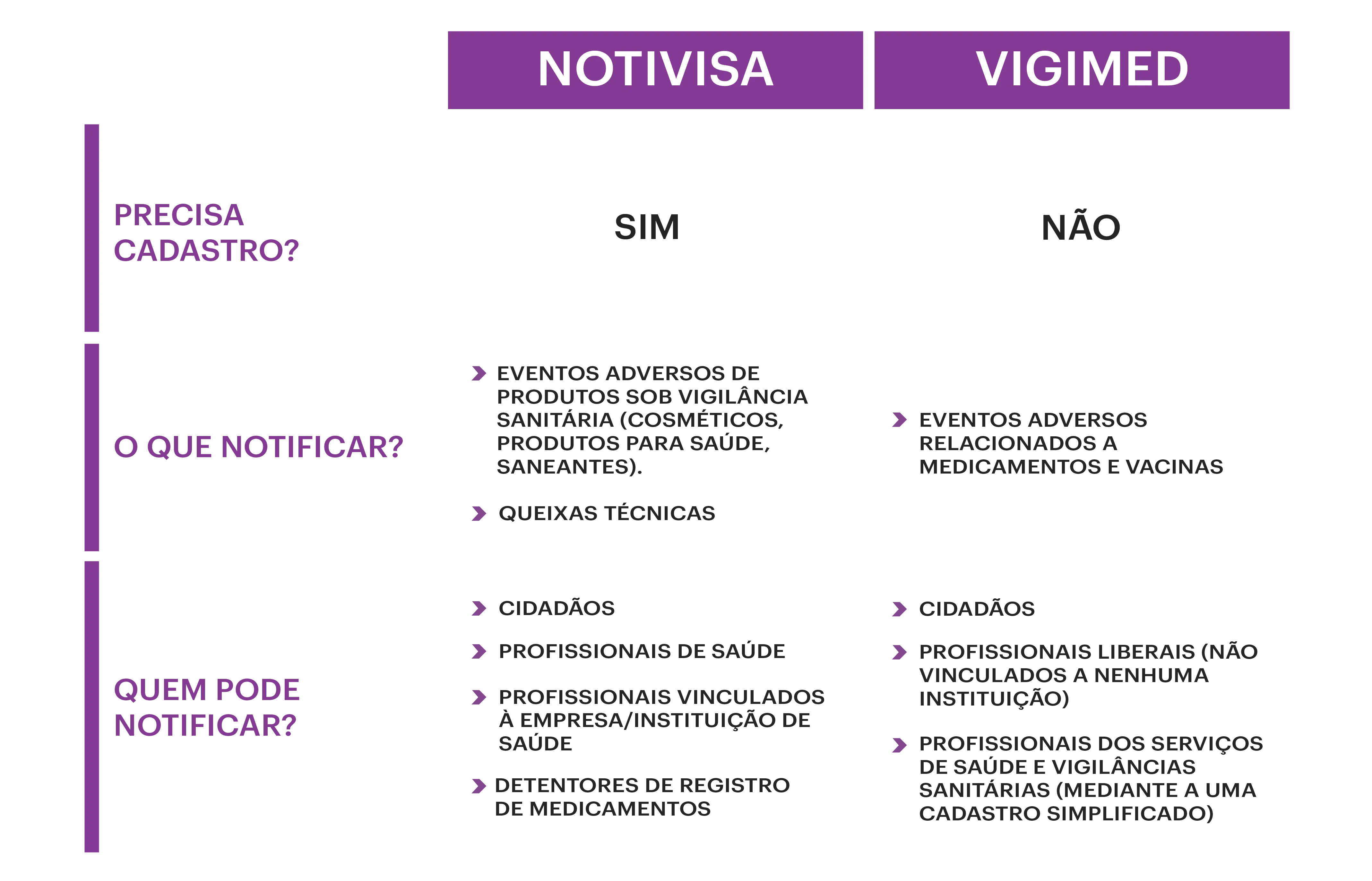
(Adaptado de Conselho Regional de Farmácia-RS, 2020.3)
Sanofi
A Sanofi acompanha e registra os eventos adversos de todos os seus medicamentos. Esse trabalho é feito pela Farmacovigilância da empresa e consiste em detectar, avaliar, compreender e prevenir eventos adversos ou qualquer outro efeito relacionado à administração de medicamentos.11
Por meio deste monitoramento constante, é possível antecipar riscos que não haviam sido identificados, avaliar a necessidade de atualização da bula do medicamento e, até mesmo, implementar alguma outra ação adicional quando necessária, como por exemplo:11
- a distribuição de cartas aos profissionais de saúde, a fim de alertar sobre um novo risco ou restrição de bula,
- o envio de materiais educacionais para os profissionais de saúde, visando a melhor orientação do paciente por meio deste profissional,
- a realização de campanhas educativas para informar a população sobre o novo risco detectado.
A notificação pode melhorar ainda mais a segurança dos medicamentos SANOFI e o farmacêutico tem um papel fundamental na atualização de informações de segurança de um medicamento ao comunicar eventos adversos apresentados pelos pacientes durante ou após o tratamento. Essas informações são tratadas de forma confidencial e contribuem para a avaliação contínua do perfil benefício-risco dos medicamentos.11

Link de acesso ao Fale Conosco: https://www.sanofi.com.br/pt/fale-conosco/
Compartilhar
-
Martins ACM.
Eventos adversos a medicamentos: bancos de dados administrativos de pacientes hospitalizados e registro de óbitos como fonte de informação.
2015. 67 f. Tese (Doutorado em Epidemiologia em Saúde Pública) - Escola Nacional de Saúde Pública Sergio Arouca, Fundação Oswaldo Cruz, Rio de Janeiro, 2015. -
Santos GAS, Boing AC.
Mortalidade e internações hospitalares por intoxicações e reações adversas a medicamentos no Brasil: análise de 2000 a 2014.
Cad. Saúde Pública [Internet]. 2018; 34( 6 ): e00100917. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-311X2018000605011&lng=en. -
Conselho Regional de Farmácia do Rio Grande do Sul - (CRF-RS).
Entenda a diferença entre Notivisa e Vigimed.
2020. Acesso em: 25/02/2021. Disponível em: https://www.crfrs.org.br/noticias/entenda-a-diferenca-entre-notivisa-e-vigimed. -
Conselho Regional de Farmácia do Estado de São Paulo (CRF-SP).
Farmacovigilância – A importância das notificações de eventos adversos e queixas técnicas de desvio de qualidade de medicamentos pelo farmacêutico.
2020. Acesso em: 25/02/2021, Disponível em: http://www.crfsp.org.br/orienta%C3%A7%C3%A3o-farmac%C3%AAutica/644-fiscalizacao-parceira/geral/11531-fiscaliza%C3%A7%C3%A3o-orientativa-223.html. -
BRASIL. Agência Nacional de Vigilância Sanitária.
Resolução RDC nº 36, de 25 de julho de 2013. Institui ações para a segurança do paciente em serviços de saúde e dá outras providências.
Diário Oficial da República Federativa do Brasil, Brasília (DF), 2013. -
Agência Nacional de Vigilância Sanitária (ANVISA).
O que é farmacovigilância?.
Acesso em: 25/02/2021. Disponível em: http://antigo.anvisa.gov.br/farmacovigilancia/saiba-mais. -
BRASIL. Agência Nacional de Vigilância Sanitária (ANVISA).
Resolução-RDC Nº 67, de 21 de dezembro de 2009. Dispõe sobre normas de tecnovigilância aplicáveis aos detentores de registro de produtos para saúde no Brasil.
Diário Oficial da República Federativa do Brasil, Brasília (DF), 2009. -
BRASIL. Agência Nacional de Vigilância Sanitária (ANVISA).
Resolução - RDC nº 140, de 29 de maio de 2003.
Republicada no DOU nº 104, de 2 de junho de 2003, Seção 1, pág. 40. -
Organização Pan-Americana da Saúde / Organização Mundial da Saúde.
Segurança dos medicamentos: um guia para detectar e notificar reações adversas a medicamentos.
Por que os profissionais de saúde precisam entrar em ação. Brasília, 2005. -
Lima, PF, Cavassini ACM, Silva FAT et al.
Queixas técnicas e eventos adversos a medicamentos notificados em um hospital sentinela do interior de São Paulo, 2009-2010. 2013.
Epidemiologia e Serviços de Saúde, 22(4), 679-686. https://dx.doi.org/10.5123/S1679-49742013000400014. -
SANOFI.
Farmacovigilância.
Acesso em: 11/03/21. Disponível em: https://www.sanofi.com.br/pt/quem-somos/ciencia-e-inovacao/farmacovigilancia#:~:text=O%20evento%20adverso%20refere%2Dse,diferente%20da%20recomendada%20em%20bula.
Referências