ARTIGO
Por que é fundamental entender a exacerbação na DPOC com Inflamação tipo 2?

Você está investigando a inflamação tipo 2 nos seus pacientes? Eosinófilos elevados no sangue podem ajudar a identificar inflamação tipo 2 na DPOC.1

aCom base nos achados de cinco estudos com pacientes de DPOC sem asma como comorbidade. Níveis de eosinófilos utilizados para definir a inflamação tipo 2 variaram de ≥300 céls./mm3 a ≥340 céls./mm3 (sangue), ≥2% (sangue e escarro), ou >3% células não escamosas (escarro). Percentual de pacientes com inflamação tipo 2 variou de 12,3% a 37%.
Exacerbações de DPOC
Pacientes com exacerbações levando à hospitalização apresentam risco mais elevado de internações hospitalares.
Após a 1ª exacerbação, cerca de 35% dos pacientes foram rehospitalizados dentro de 90 dias.3-5,c
Exacerbações da DPOC estão associadas com a piora dos sintomas e aumento dos riscos, o que impacta seriamente a qualidade de vida dos pacientes.1,6-9
Pacientes geralmente apresentam:c
- Níveis de atividade e capacidade de exercícios limitados6
- Fadiga
- Distúrbios relacionados ao sono8,9
- Ansiedade e depressão8
cCom base em dados de uma investigação que examinou os resultados (mortalidade intra-hospitalar e pós-alta de 90 dias e readmissão em 90 dias) em pacientes com uma exacerbação grave da DPOC (n=15.191) observados dentro da Auditoria Europeia de DPOC.3
O risco do paciente exacerbar aumenta após cada exacerbação:
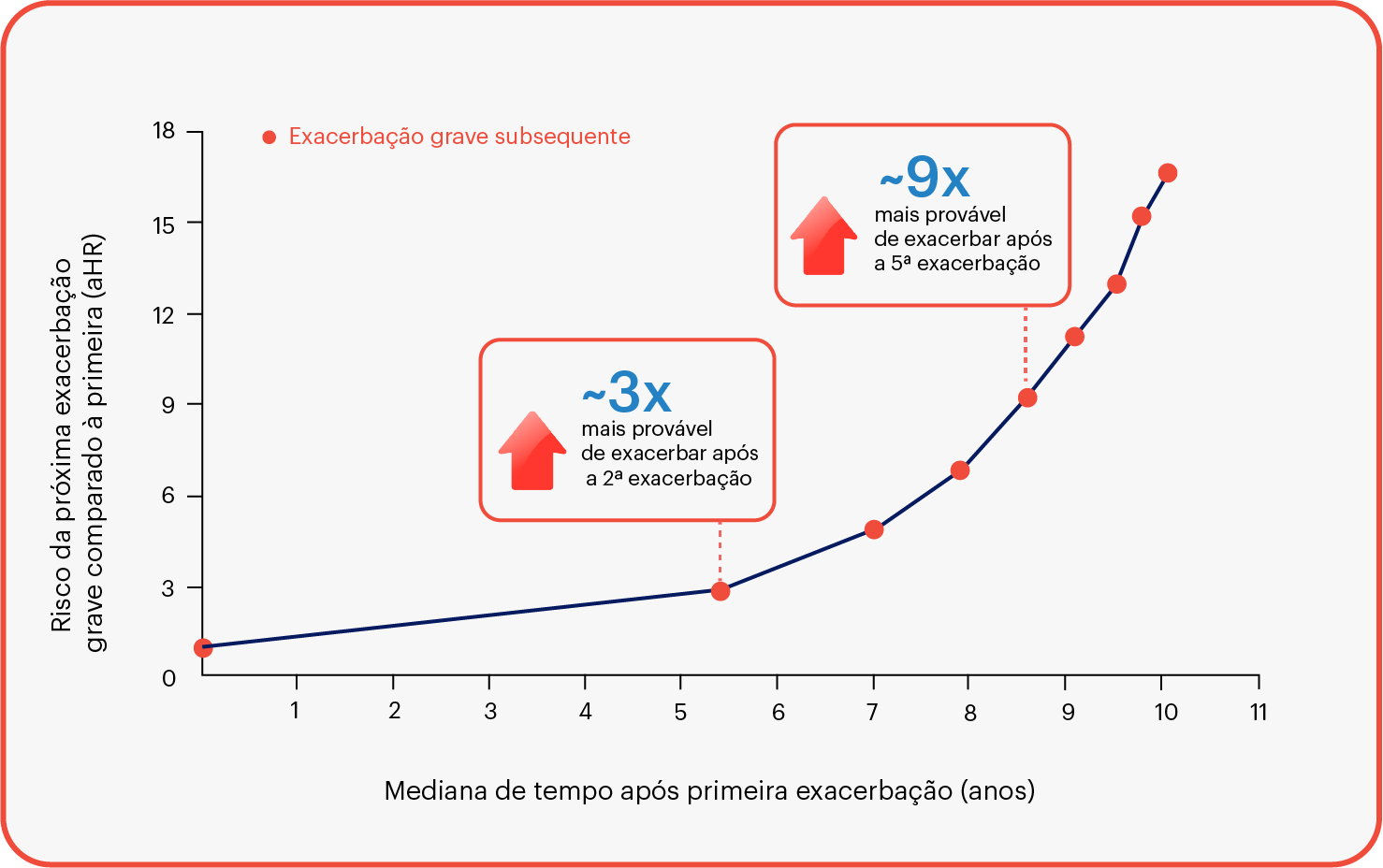
Baseado em dados de uma coorte populacional de 73.106 pacientes canadenses que foram hospitalizados pela primeira vez devido a uma exacerbação grave de DPOC (1990-2005, acompanhados até a morte ou 31/03/2007) com mediana de acompanhamento de 3.6 anos (range 1 dia a 17 anos). Idade média dos pacientes era 75 anos.
*Ajustado para idade, sexo, tempo e escore de doença crônica modificado.
Exacerbações podem aumentar o risco de mortalidade1
- Depois da segunda exacerbação: ~2x risco maior
- Depois da sexta exacerbação: ~3x risco maior
Os dados de mortalidade por todas as causas mostram:f
50% dos pacientes foram a óbito num intervalo de até 4 anos após a primeira exacerbação grave relacionada à DPOC1,d
dCom base em dados de uma grande coorte populacional de 73.106 pacientes canadenses que foram hospitalizados pela primeira vez devido a uma exacerbação grave da DPOC (1990-2005, seguidos até a morte ou 31 de março de 2007), com um acompanhamento médio de 3,6 anos (intervalo de 1 dia a 17 anos). A idade média dos pacientes neste estudo retrospectivo era de 75 anos.
eRisco relativo de mortalidade em comparação com a primeira exacerbação (razão de risco ajustada).
fA sobrevida mediana foi de 3,6 anos.

aResultados de uma análise observacional de 1.553 pacientes com espirometria dentro dos níveis2-4 do GOLD, avaliando a relação entre níveis de eosinófilos no sangue e risco de exacerbações.
bAnálise estratificada confirmou um maior risco de exacerbações em indivíduos com histórico de exacerbações frequentes, definido como ≥2 exacerbações por ano.
- Eosinófilos aumentados e histórico de exacerbações frequentes ajudam a identificar pacientes e a orientar as opções de tratamento.9,5,2
- De acordo com as recomendações do GOLD 2024, pacientes com exacerbações frequentes (Grupo E do GOLD) e eosinófilos elevados no sangue (≥300 CÉLS./mm3) podem receber um corticoide inalatório em combinação com LABA + LAMA.9
- Mesmo quando o tratamento é otimizado com a Tríplice Terapia Inalatória, muitos pacientes com DPOC continuam exacerbando.5,2
- Entender a inflamação tipo 2 na DPOC traz uma nova luz sobre os motivos pelo quais pacientes continuam a exacerbar.18,19
- Suissa S, Dell’Anello S, Ernst P.
Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality.
Thorax. 2012;67(11):957-963. - Hartl S, Lopez-Campos JL, Pozo-Rodriguez F, et al.
Risk of death and readmission of hospital-admitted COPD exacerbations: European COPD Audit.
Eur Respir J. 2016;47(1):113-121. - Shah T, Churpek MM, Peraillon MC, Konetzka RT.
Understanding why patients with COPD get readmitted. A large national study to delineate the Medicare population for the readmissions penalty expansion.
Chest. 2015;147(5):1219-1226. - Higham A, Quinn AM, Cançado JED, Singh D.
The pathology of small airways disease in COPD: historical aspects and future directions.
Respir Res. 2019;20(1):49. doi:10.1186/s12931-019-1017-y - Press VG, Myers LC, Feemster LC.
Preventing COPD readmissions under the Hospital Readmissions Reduction Program. How far have we come?
Chest. 2021;159(3):996-1006. - Jones SE, Barker RE, Nolan CM, Patel S, Maddocks M, Man WDC.
Pulmonary rehabilitation in patients with an acute exacerbation of chronic obstructive pulmonary disease.
J Thorac Dis. 2018;10(suppl 12):S1390-S1399. - Goërtz YMJ, Spruit MA, Van’t Hul AJ, et al.
Fatigue is highly prevalent in patients with COPD and correlates poorly with the degree of airflow limitation.
Ther Adv Respir Dis. 2019;13:1753466619878128. - Miravitlles M, Worth H, Soler Cataluña JJ, et al.
Observational study to characterise 24-hour COPD symptoms and their relationship with patient-reported outcomes: results from the ASSESS study.
Respir Res. 2014;15(1):122. - Brightling CE, Saha S, Hollins F.
Interleukin-13: prospects for new treatment.
Clin Exp Allergy. 2010;40(1):42-49. - Cosio Piqueras MG, Cosio MG.
Disease of the airways in chronic obstructive pulmonary disease.
Eur Respir J. 2001;18(suppl 34):41s-49s - Oishi K, Matsunaga K, Shirai T, Hirai K, Gon Y.
Role of type 2 inflammatory biomarkers in chronic obstructive pulmonary disease.
J Clin Med. 2020;9(8):2670. - Yousuf A, Ibrahim W, Greening NJ, Brightling CE.
T2 biologics for chronic obstructive pulmonary disease.
J Allergy Clin Immunol Pract. 2019;7(5):1406-1416. - Barnes PJ.
Inflammatory endotypes in COPD.
Allergy. 2019;74(7):1249-1256. - Gabryelska A, Kuna P, Antczak A, Białasiewicz P, Panek M.
IL-33 mediated inflammation in chronic respiratory diseases—understanding the role of the member of IL-1 superfamily.
Front Immunol. 2019;10:692. - Allinne J, Scott G, Lim WK, et al.
IL-33 blockade affects mediators of persistence and exacerbation in a model of chronic airway inflammation.
J Allergy Clin Immunol. 2019;144(6):1624-1637.e10. - Calderon AA, Dimond C, Choy DF, et al.
Targeting interleukin-33 and thymic stromal lymphopoietin pathways for novel pulmonary therapeutics in asthma and COPD.
Eur Respir Rev. 2023;32(167):220144. - Yun JH, Lamb A, Chase R, et al; for the COPDGene and ECLIPSE Investigators.
Blood eosinophil count thresholds and exacerbations in patients with chronic obstructive pulmonary disease.
J Allergy Clin Immunol. 2018;141(6):2037-2047.e10. - Bélanger M, Couillard S, Courteau J, et al.
Eosinophil counts in first COPD hospitalizations: a comparison of health service utilization.
Int J Chron Obstruct Pulmon Dis. 2018;13:3045-3054. - Global Initiative for Chronic Obstructive Lung Disease.
Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (2024 report).
Accessed [March 25, 2024]. https://goldcopd.org/wp-content/uploads/2024/02/GOLD-2024_v1.2-11Jan24_WMV.pdf. - Oshagbemi OA, Franssen FME, van Kraaij S, et al.
Blood eosinophil counts, withdrawal of inhaled corticosteroids and risk of COPD exacerbations and mortality in the clinical practice research datalink (CPRD).
COPD. 2019;16(2):152-159. - Casanova C, Celli BR, de-Torres JP, et al.
Prevalence of persistent blood eosinophilia: relation to outcomes in patients with COPD.
Eur Respir J. 2017;50:1701162. - Singh D, Kolsum U, Brightling CE, Locantore N, Agusti A, Tal-Singer R; on behalf of the ECLIPSE investigators.
Eosinophilic inflammation in COPD: prevalence and clinical characteristics.
Eur Respir J. 2014;44(6):1697-1700. - Bafadhel M, McKenna S, Terry S, et al.
Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers.
Am J Respir Crit Care Med. 2011;184(6):662-671. - Oshagbemi OA, Burden AM, Braeken DCW, et al.
Stability of blood eosinophils in patients with chronic obstructive pulmonary disease and in control subjects, and the impact of sex, age, smoking, and baseline counts.
Am J Respir Crit Care Med. 2017;195(10):1402-1404.
Referências:
 nas abas abaixo para navegar pelo conteúdo disponível nesta seção da página. A aba em destaque mostrará o conteúdo correspondente a cada título:
nas abas abaixo para navegar pelo conteúdo disponível nesta seção da página. A aba em destaque mostrará o conteúdo correspondente a cada título:

