ARTIGO
A importância do monitoramento de drogas terapêuticas no tratamento de infecções graves

O monitoramento de drogas terapêuticas consiste na dosagem de drogas específicas com intervalos pré-determinados a fim de manter uma concentração constante do medicamento na corrente sanguínea, a seguir: monitoramento e utilização na prática clínica de TDM (sigla em inglês) - monitoramento de drogas terapêuticas.

Dr. Ivan França
CRM-SP 93300
Médico infectologista. Doutor em Ciências pela Faculdade de Medicina da Universidade de São Paulo (FMUSP). Chefe do Departamento de Infectologia e do Serviço de Controle de Infecção Hospitalar do A.C. Camargo Câncer Center. Médico assistente da UTI do Instituto de Infectologia Emílio Ribas.

Dr. João Paulo Marochi Telles
CRM-SP 172743
Médico infectologista do Hospital A.C. Camargo Câncer Center.
Medicina de precisão
Medicina de precisão é o termo usado para descrever o tratamento individualizado que engloba o uso de novos métodos diagnósticos e terapêuticos direcionados às necessidades do paciente com base em suas características genéticas, biomarcadoras, fenotípicas ou psicossociais.1
Esse conceito se associa ao princípio de stewardship de antimicrobianos, algo que parece simples: fornecimento da droga certa, na dose certa e ao paciente certo.2
Monitoramento de drogas terapêuticas (TDM)
Existem variabilidades genéticas, fisiológicas e metabólicas entre os indivíduos, e elas podem influenciar diretamente a resposta terapêutica de infecções similares em pacientes diferentes. Ou seja, um mesmo medicamento, em dose e frequência iguais, em um paciente jovem e sem comorbidades pode apresentar resposta terapêutica diferente em comparação ao mesmo regime em um paciente idoso com comorbidades.
Entre os pacientes, cada situação clínica apresentada gera uma diferente distribuição da droga em cada organismo, o que demonstra que a distribuição ocorre de forma heterogênea. Assim, cada situação é única e deve ser avaliada com cautela conforme o metabolismo e a distribuição do indivíduo.
O monitoramento de drogas terapêuticas (TDM, na sigla em inglês) consiste na dosagem sérica de drogas específicas com intervalos predeterminados a fim de manter uma concentração específica para cada medicamento na corrente sanguínea.3
Para manter esse estado de equilíbrio, nem sempre é suficiente a administração de uma dose padronizada do medicamento. Cada indivíduo absorve, metaboliza, distribui e elimina medicamentos em taxas diferentes, que variam em razão de idade, estado geral de saúde e constituição genética, além da interferência de outros medicamentos que esteja utilizando.3 Essas taxas podem alterar-se com o tempo e variam no dia a dia.
Quando se trata de combate a infecções, é de suma importância a otimização da dosagem antimicrobiana. Para isso, deve-se levar em conta as características individuais do paciente, as características do microrganismo causador, o local da infecção e as características farmacocinéticas e farmacodinâmicas da droga.2
A escolha da dosagem dos medicamentos baseada em fatores como peso, área de superfície corporal ou comprometimento de órgãos pode nem sempre ser suficiente para superar a variabilidade individual.4
Como utilizar o TDM na prática clínica
Na prática clínica, temos disponíveis exames de dosagem sérica de poucos medicamentos, e os monitorados com mais frequência são os anticonvulsivantes e os imunossupressores.5 Algumas das razões do número relativamente baixo de medicamentos com níveis séricos monitorados rotineiramente são: a difícil interpretação dos resultados e o manejo das doses subsequentes.5 Os dados de TDM são frequentemente usados para ajustar os regimes de dose com a utilização de cálculos farmacocinéticos bastante desafiadores ou mesmo de modelos farmacocinéticos de população e previsão de certos bayes incorporados a pacotes de software sofisticados.5-7
Individualmente, pacientes podem se beneficiar de ajustes de dose baseados na rápida determinação de níveis séricos que são comparados com os escassos dados disponíveis de farmacocinética.5
Os medicamentos monitorados tendem a apresentar um “intervalo terapêutico” relativamente estreito, ou seja, a quantidade necessária para alcançar o efeito desejado não está muito distante daquela capaz de causar efeitos colaterais significativos ou mesmo sinais de intoxicação.8 O voriconazol, um antifúngico amplamente utilizado em imunocomprometidos, tem limites terapêuticos e tóxicos aproximados e grande variabilidade conforme o estado dinâmico do paciente.8,9
Farmacocinética e farmacodinâmica (PK/PD)
Desde o momento em que um antibiótico é administrado a um paciente, ele passa por alguns processos que condicionam suas concentrações plasmáticas e teciduais e, portanto, o desfecho clínico.10
A evolução da concentração do fármaco nos diversos fluidos corporais do paciente ao longo do tempo é estudada pela farmacocinética (PK), o que podemos colocar de maneira simples como “o que o corpo faz com a droga”. Depois da administração, a droga passa por processos (absorção, distribuição, metabolismo e excreção) que condicionam a cinética do fármaco e do perfil concentração-tempo, o que pode ser caracterizado pelos parâmetros farmacocinéticos, como depuração corporal total, volume de distribuição, ligação às proteínas ou biodisponibilidade.10,11
Uma vez que o medicamento atinge o local de ação na concentração requerida, produz o efeito desejável por seu mecanismo de ação, o que é estudado pela farmacodinâmica (PD) e conhecido como “o que a droga faz no corpo”.11,12
Na terapia antimicrobiana, o efeito é produzido sobre o patógeno bacteriano responsável pela infecção. O principal indicador do efeito dos antibióticos é a concentração inibitória mínima (MIC, na sigla em inglês).11
A relação quantitativa entre um parâmetro farmacocinético e um parâmetro microbiológico é conhecida como índice PK/PD.10
Os três principais índices PK/PD associados ao efeito dos antibióticos na predição da eficácia do tratamento são: o tempo durante o qual a concentração da droga livre permanece acima da MIC (T>MIC), a relação entre pico de concentração e MIC (Cmáx/MIC) e a área sob a curva de concentração-tempo dividida pela MIC (AUC/MIC).11,13,14 (Figura 1)
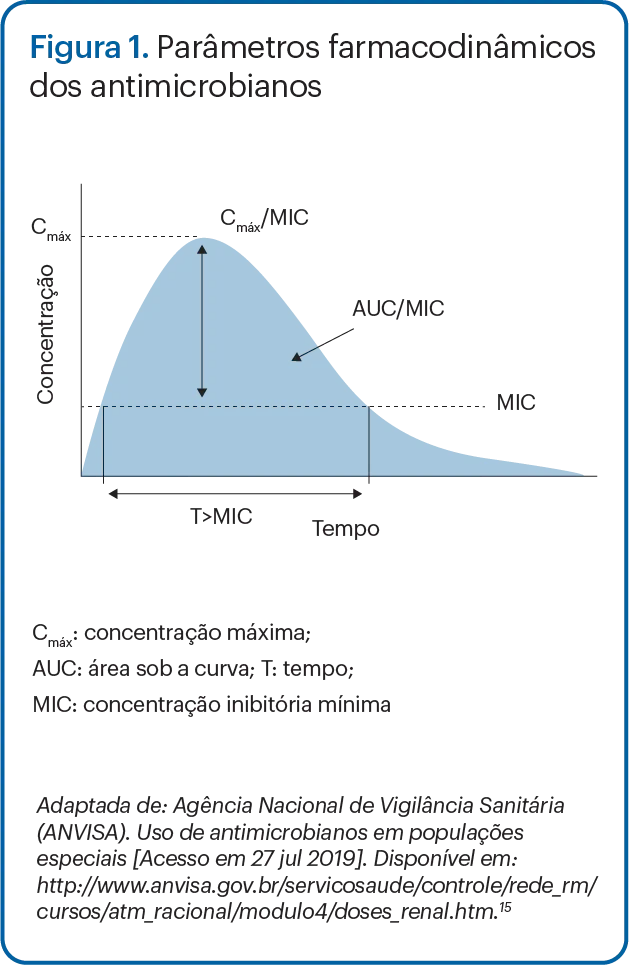
Os termos farmacocinéticos importantes incluem: volume de distribuição (Vd), não um volume fisiológico, e sim uma constante de proporcionalidade que relaciona a concentração sérica do fármaco a suas concentrações corporais; depuração, o processo de eliminação do fármaco (por exemplo, metabolismo hepático e filtração renal) do corpo ao longo do tempo (por exemplo, volume de fluido eliminado da droga ao longo do tempo); meia-vida (t1/2), o tempo em que a concentração sérica do fármaco diminui até a metade; concentração máxima (Cmáx), pico ou concentração sanguínea mais alta após uma dose; concentração mínima (Cmín), “vale” ou a menor concentração sanguínea imediatamente antes da próxima dose; e área sob a curva (AUC), a presença total do fármaco no sangue e no corpo durante um período de 24 horas. (Tabela 1)
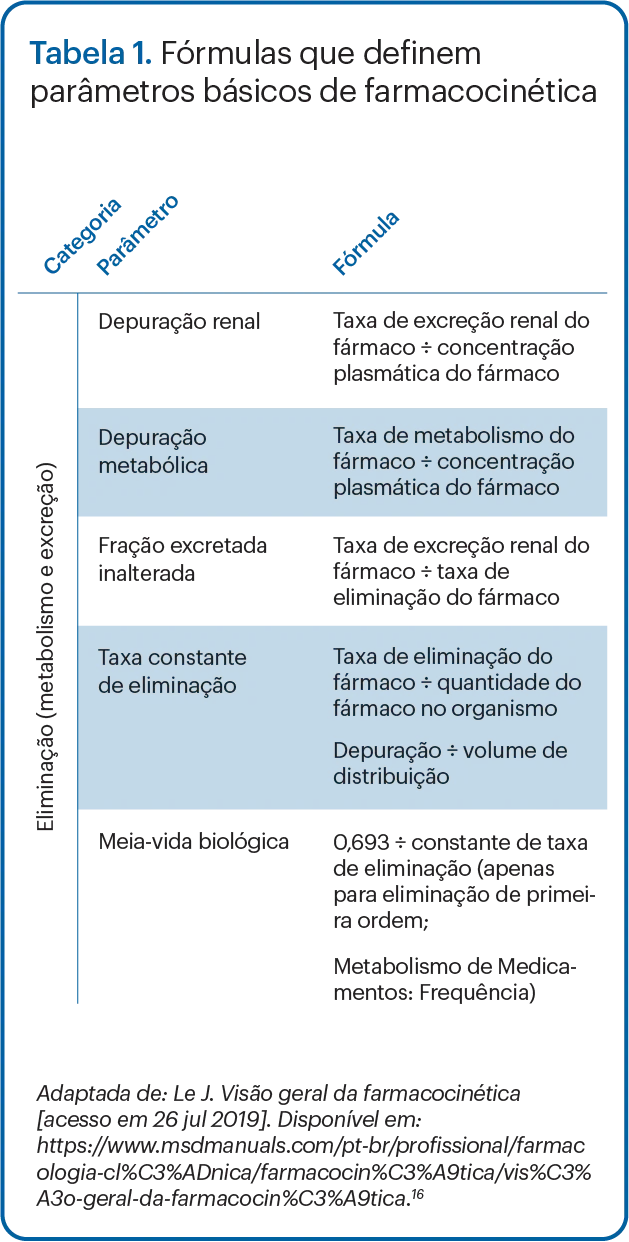
As alterações desses parâmetros farmacocinéticos afetam a capacidade dos antibióticos de penetrar nos locais de infecção e atingir concentrações sufcientes.10,11
Apesar de existirem poucos dados prospectivos randomizados disponíveis que demonstrem o efeito benéfico do TDM de rotina, a maioria dos dados publicados sugere que o TDM pode beneficiar os pacientes.17-19
O TDM no paciente crítico
No caso dos pacientes críticos, podem ocorrer alterações fisiopatológicas com a progressão da doença, afetando a absorção, a distribuição, o metabolismo e a excreção da droga e, consequentemente, a resposta à medicação.4
A sepse está associada a mortalidade acentuada, que pode ser reduzida pelo início imediato de doses apropriadas do antibiótico correto.20 Esses pacientes gravemente doentes frequentemente apresentam alterações fisiológicas, além de vasodilatação, que reduzem as concentrações séricas e teciduais dos antibióticos, bem como altas taxas de patógenos resistentes a múltiplos fármacos, o que pode afetar os desfechos.21,22
No tratamento integrado dos pacientes que estão em cuidados intensivos, com infecções graves, os componentes da equipe multiprofissional (médicos, enfermeiros, farmacêuticos clínicos e microbiologistas) devem entender a farmacocinética e a farmacodinâmica dos antibióticos.22
Devem, por meio desse conhecimento, assegurar a prescrição da dosagem adequada dos antibióticos e a adoção de estratégias de administração que garantam a erradicação efetiva dos patógenos. Isso ocorre quando a dose de antibiótico alcança ou mantém as concentrações ótimas em relação à concentração inibitória mínima do patógeno.22
Deve-se individualizar o esquema terapêutico considerando-se as alterações farmacodinâmicas dos antibióticos no paciente crítico. A utilização de medidas de função renal pode ser um dos critérios de adequação de drogas que apresentam maior probabilidade de sobrecarga renal. Nesse caso, deve-se utilizar clearance de 8, 12 ou 24 horas, evitando-se o uso de fórmulas para estimar a função renal. Recomenda-se, todavia, a dosagem de níveis séricos de algumas drogas para melhor adequação terapêutica e menor dano renal, como glicopeptídeos e aminoglicosídeos.23
Para a otimização da administração de antibióticos nos pacientes críticos, é necessário considerar as diversas classes e as características farmacocinéticas dos antibióticos associados à reavaliação do regime recomendado.23 Alguns autores sugerem a administração da dose máxima dos antimicrobianos em certos casos ou da dose de ataque no tratamento dessas condições clínicas.24,25
Deve-se lembrar que a ação bactericida ou bacteriostática dos antimicrobianos depende de características diferentes, conforme a classe considerada. Assim, a melhor ação pode ser alcançada pela relação concentração máxima antimicrobiana (Cmáx)/concentração inibitória mínima (MIC), como ocorre no caso dos aminoglicosídeos, pelo tempo de concentração do antimicrobiano acima da MIC (tempo-dependente), como é o caso dos β-lactâmicos, e pela combinação de concentração e tempo, medida pela área sob a curva acima da MIC, como ocorre com as fluoroquinolonas.23
Os antibióticos dependentes do tempo, como os β-lactâmicos, podem ser administrados como infusões prolongadas ou contínuas. Os antibióticos dependentes de concentração, como os aminoglicosídeos, são otimizados pelo uso de estratégias de dosagem alta, uma vez ao dia, com
monitoramento da concentração sérica.22,23
A vancomicina e as fluoroquinolonas dependem tanto do tempo quanto da concentração acima da concentração inibitória mínima.23
A mudança para um tratamento anti-infeccioso individualizado no caso dos pacientes críticos com o uso de TDM é inevitável.
O TDM ideal no tratamento com teicoplanina
No caso da teicoplanina, concentrações de vale de 10 mg/L devem ser rapidamente alcançadas no tratamento de bacteremia por estafilococos nos pacientes críticos. Concentrações entre 20 e 30 mg/dL devem ser precocemente asseguradas na presença de infecções em sítios mais profundos, como endocardite, artrite séptica ou mesmo pneumonia, e/ou de patógenos suscetíveis limítrofes.26,27
Como a teicoplanina requer tempo considerável para atingir concentrações em estado estacionário, o regime de dosagem recomendado inclui dose de ataque de 6 mg/kg, administrada três vezes em intervalos de 12 horas e seguida de dose única diária de pelo menos 6 mg/kg.28
Portanto, deve ser realizada dose de ataque nos pacientes críticos e a coleta de amostra para TDM deve ser realizada a partir da primeira dose de manutenção.26 Amostras devem ser colhidas frequentemente, ao menos duas vezes por semana, especialmente se houver alteração de funções de órgãos.26
Um estudo que envolveu 450 pacientes na Europa detectou alta variabilidade da fração livre da teicoplanina em pacientes graves, principalmente nos que apresentavam hipoalbuminemia. Tal situação reforça a necessidade de individualização da antibioticoterapia, pois cada paciente apresenta características particulares.13
As doses de ataque apropriadas são essenciais para atingir concentrações séricas terapêuticas adequadas independentemente da função renal.28
Depois disso, o TDM pode ser importante para assegurar a otimização dos regimes posológicos de acordo com as necessidades individuais dos pacientes.28
As concentrações séricas de teicoplanina durante os primeiros dias de tratamento são diretamente influenciadas pela dose/kg administrada, porém, a partir do quarto dia, essas concentrações são também influenciadas pela depuração renal.28
Após a administração das doses de ataque iniciais de teicoplanina nos primeiros dois dias, as doses de manutenção devem ser ajustadas de acordo com o clearance de creatinina e os resultados do TDM nos dias subsequentes para evitar subdose ou overdose.28
Nah et al.29 relataram o primeiro estudo sobre o TDM da teicoplanina no cenário clínico com pacientes coreanos e enfatizaram a importância da dose de carga e do TDM de rotina da teicoplanina. Além disso, focaram o papel do TDM na eficácia terapêutica ótima do medicamento,29 e não para evitar efeitos adversos. Uma das limitações desse estudo foi a não avaliação da associação entre as concentrações plasmáticas de teicoplanina e os efeitos terapêuticos clínicos.29 Um valor de AUC/CIM de teicoplanina em relação a estaflococos foi considerado importante parâmetro farmacodinâmico.30
O TDM da terapia com vancomicina demonstrou constituir um procedimento de baixo custo.31 No entanto, um estudo sobre o custo efetivo do TDM de teicoplanina ainda não foi publicado. Podemos considerar que o TDM de teicoplanina tem a mesma importância clínica do TDM de vancomicina.
A otimização da dose dos antimicrobianos com base nas características individuais do paciente, no microrganismo causador, no local da infecção e nas características farmacocinéticas e farmacodinâmicas da droga é uma parte importante do stewardship antimicrobiano.
O aumento da resistência contra múltiplos antibióticos atualmente disponíveis está levando a uma rápida perda de opções para tratamento de infecções graves, principalmente as adquiridas em estabelecimentos de saúde. Como a resistência aos antibióticos se deve parcialmente ao uso indevido ou ao abuso de antibióticos, essa situação pode ser revertida com a melhora de seu uso.
Uma estratégia é a otimização e individualização dos regimes de dosagem antimicrobiana.
Compartilhar
-
Jameson JL, Longo DL.
Precision medicine – personalized, problematic, and promising.
N Engl J Med. 2015 Jun 4;372(23):2229-34. -
Dellit TH, Owens RC, McGowan JE, Gerdinger DN, Weinstein RA, Burke JP, et al.
Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship.
Clin Infect Dis. 2007;44(2):159-77. -
Kang JS, Lee MH.
Overview of therapeutic drug monitoring.
Korean J Intern Med. 2009;24(1):1-10. -
Jang SH, Yan Z, Lazor JA.
Therapeutic drug monitoring: a patient management tool for precision medicine.
Clin Pharmacol Ther. 2016;99(2):148-50. -
Cremers S, Guha N, Shine B.
Therapeutic drug monitoring in the era of precision medicine: opportunities!
Br J Clin Pharmacol. 2016;82:900-2. -
Cremers S, Schoemaker R, Bredius R, den Hartigh J, Ball L, Twiss I, et al.
Pharmacokinetics of intravenous busulfan in children prior to stem cell transplantation.
Br J Clin Pharmacol. 2002;53:386-9. -
Hahn A, Frenck RW Jr., Zou Y, Vinks AA.
Validation of a pediatric population pharmacokinetic model for vancomycin.
Ther Drug Monit. 2015;37(3):413-6. -
Stott KE, Hope WW.
Therapeutic drug monitoring for invasive mould infections and disease: pharmacokinetic and pharmacodynamic considerations.
J Antimicrob Chemother. 2017;72(suppl_1):i12-i18. -
Job KM, Olson J, Stockmann C, Constance JE, Enioutina EY, Rower JE, et al.
Pharmacodynamic studies of voriconazole: informing the clinical management of invasive fungal infections.
Expert Rev Anti Infect Ther. 2016;14(8):731-46. -
Blot SI, Pea F, Lipman J.
The effect of pathophysiology on pharmacokinetics in the critically ill patient-concepts appraised by the example of antimicrobial agents.
Adv Drug Deliv Rev. 2014;77:3-11. -
Levison ME, Levison JH.
Pharmacokinetics and pharmacodynamics of antibacterial agents.
Infect Dis Clin North Am. 2009;23(4):791-815, vii. -
Craig WA.
Pharmacokinetic/pharmacodynamic parameters: rationale for antibacterial dosing of mice and men.
Clin Infect Dis. 1998;26(1):1-10; quiz 11-2. -
Roberts JA, Stove V, De Waele JJ, Sipinkoski B, McWhinney B, Ungerer JPJ, et al.
Variability in protein binding of teicoplanin and achievement of therapeutic drug monitoring targets in critically ill patients: Lessons from the DALI Study.
Int J Antimicrob Agents. 2014;43(5):423-30. -
Onufrak NJ, Forrest A, Gonzalez D.
Pharmacokinetic and pharmacodynamic principles of anti-infective dosing.
Clin Ther. 2016;38(9):1930-47. -
Agência Nacional de Vigilância Sanitária (ANVISA).
Uso de antimicrobianos em populações especiais [Acesso em 27 jul 2019].
Disponível em: http://www.anvisa.gov.br/servicosaude/controle/rede_rm/cursos/atm_racional/modulo4/doses_renal.htm. -
Le J.
Visão geral da farmacocinética [acesso em 26 jul 2019].
Disponível em: https://www.msdmanuals.com/pt-br/profssional/farmacologia-cl%C3%ADnica/farmacocin%C3%A9tica/vis%C3%A3o-geralda-farmacocin%C3%A9tica. -
Bardin C, Veal G, Paci A, Chatelut E, Astier A, Leveque D, et al.
Therapeutic drug monitoring in cancer – are we missing a trick?
Eur J Cancer. 2014;50:2005-9. -
Huttner A, Harbarth S, Hope WW, Lipman J, Roberts JA.
Therapeutic drug monitoring of the β-lactam antibiotics: what is the evidence and which patients should we be using it for?
J Antimicrob Chemother. 2015;70(12):3178-83. -
Bartal C, Danon A, Schlaeffer F, Reisenberg K, Alkan M, Smoliakov R, et al.
Pharmacokinetic dosing of aminoglycosides: a controlled trial.
Am J Med. 2003;114(3):194-8. -
Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S, et al.
Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock.
Crit Care Med. 2006;34(6):1589-96. -
Vázquez M, Fagiolino P, Boronat A, Buroni M, Maldonado C.
Therapeutic drug monitoring of vancomycin in severe sepsis and septic shock.
Int J Clin Pharmacol Ther. 2008;46(3):140-5. -
Droege ME, Van Fleet SL, Mueller EW.
Application of antibiotic pharmacodynamics and dosign principles in patients with sepsis.
Crit Care Nurse. 2016;36(2):22-32. -
Roberts JA, Lipman J.
Pharmacokinetic issues for antibiotics in the critically ill patient.
Crit Care Med. 2009;37(3):840-51. -
Taccone FS, Laterre PF, Spapen H, Dugernier T, Delattre I, Layeux B, et al.
Revisiting the loading dose of amikacin for patients with severe sepsis and septic shock.
Crit Care. 2010;14(2):R53. -
Roberts JA, Kirkpatrick CM, Roberts MS, Dalley AJ, Lipman J.
First-dose and steady-state population pharmacokinetics and pharmacodynamics of piperacillin by continuous or intermittent dosing in critically ill patients with sepsis.
Int J Antimicrob Agents. 2010;35(2):156-63. -
Jager GLN, van Hest RM, Lipman J, Taccone FS, Roberts JA.
Therapeutic drug monitoring of anti-infective agents in critically ill patients.
Expert Rev Clin Pharmacol. 2016; 9(7):961-79. -
Pea F, Viale P.
Pharmacodynamics of antibiotics to treat multidrug-resistant Gram-positive hospital infections.
Exp Rev Anti Infect Ther. 2007;5(2):255-70. -
Pea F, Brollo L, Viale P, Pavan F, Furlanut M.
Teicoplanin therapeutic drug monitoring in critically ill patients: a retrospective study emphasizing the importance of a loading dose.
J Antimicrob Chemother. 2003;51(4):971-5. -
Nah SY, Im JH, Yeo JY, Baek JH, Kim CW, Nam MS, et al.
Therapeutic drug concentrations of teicoplanin in clinical settings.
Infect Chemother. 2014;46(1):35-41. -
Kuti JL, Kiffer CR, Mendes CM, Nicolau DP.
Pharmacodynamic comparison of linezolid, teicoplanin and vancomycin against clinical isolates of Staphylococcus aureus and coagulase-negative staphylococci collected from hospitals in Brazil.
ClinMicrobiol Infect. 2008;14(2):116-23. -
de Gatta MDMF, Calvo MV, Hernández JM, Caballero D, San Miguel JF, Domínguez-Gil A.
Cost-effectiveness analysis of serum vancomycin concentration monitoring in patients with hematologicmalignancies.
Clin Pharmacol Ther. 1996;60(3):332-40.
Referências