A asma e a doença pulmonar obstrutiva crônica (DPOC) são doenças crônicas que obstruem as vias respiratórias e interferem na respiração.1,2 Em alguns pacientes, as duas condições compartilham uma via inflamatória tipo 2 comum, com até 88% dos pacientes com asma e até 40% dos pacientes com DPOC apresentando inflamação tipo 2.3,4 Embora as duas doenças possam compartilhar algumas características clínicas, a asma e a DPOC são doenças distintas.
Definições de Asma e DPOC, segundo GINA e GOLD, respetivamente:
Asma1
Global Initiative for Asthma (GINA)
A asma é uma doença heterogênea, geralmente caracterizada por inflamação crônica das vias aéreas. É definida pela história de sintomas respiratórios, como sibilância, falta de ar, aperto no peito e tosse, que variam ao longo do tempo e em intensidade, juntamente com limitação variável ao fluxo aéreo expiratório.

DPOC2
Global Initiative for Chronic Obstructive Lung Disease (GOLD)
A Doença Pulmonar Obstrutiva Crônica (DPOC) é uma condição pulmonar heterogênea caracterizada por sintomas respiratórios crônicos (dispneia, tosse, aumento da produção de escarro e/ou exacerbações) devido a anormalidades das vias aéreas (bronquite, bronquiolite) e/ou alvéolos (enfisema pulmonar) que causam obstrução persistente, muitas vezes progressiva, ao fluxo aéreo.
A asma e a DPOC são preocupações globais de saúde prevalentes.
Asma
O início geralmente ocorre
antes dos 40 anos de idade.
~262 milhões de casos (maioria dos casos em pacientes com idade entre 5-9 anos)
DPOC
O início usualmente ocorre após os 40 anos de idade em média.
~392 milhões de casos (pacientes com idades entre 30-79 anos)
Diferenças
Orientações para o Diagnóstico Diferencial de Asma e DPOC segundo o GOLD 20242
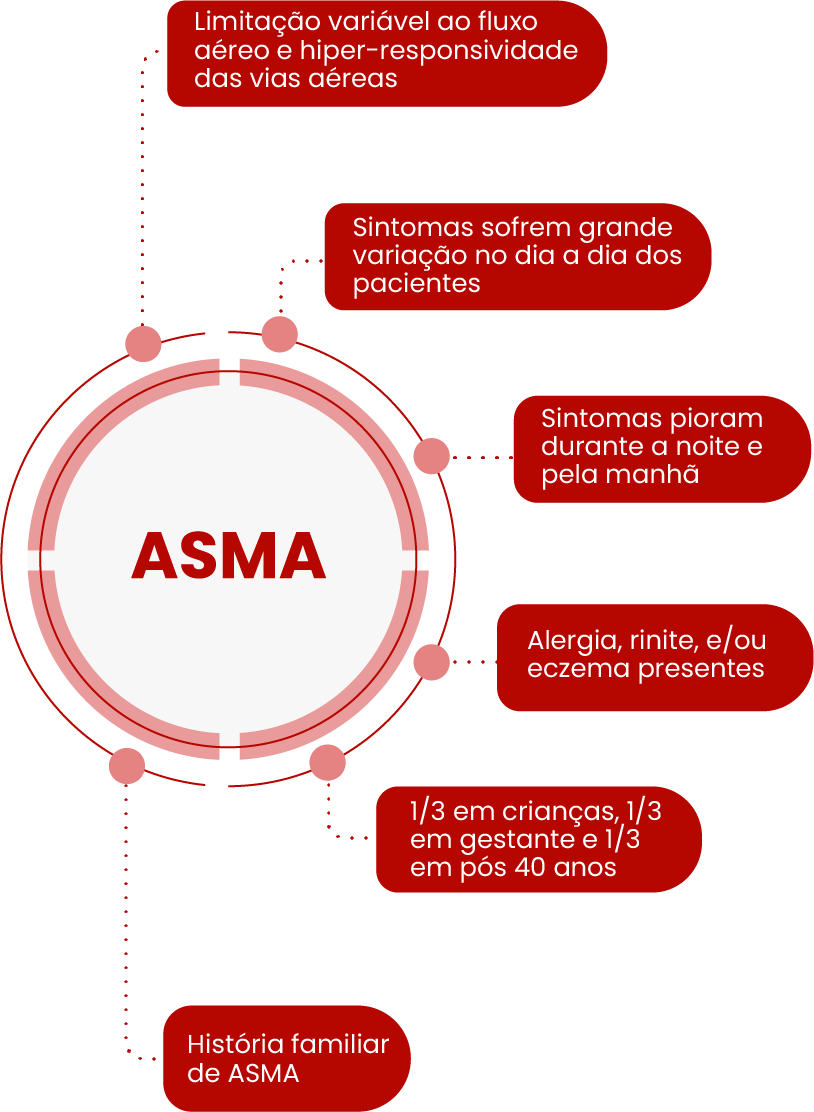
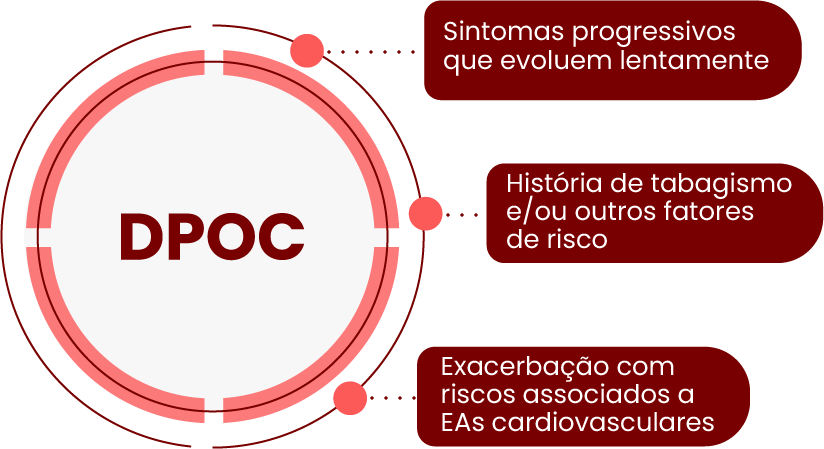
Uma análise mais detalhada dos fatores de diferenciação
Idade do paciente:
Para a asma, o início da doença geralmente ocorre antes dos 40 anos de idade. A prevalência da asma é mais alta em pacientes com idade entre 5 e 9 anos.1 Para a DPOC, o início da doença geralmente ocorre após os 40 anos de idade. A maioria das pessoas com DPOC tem entre 50 e 69 anos. Quase 90% das mortes por DPOC em pessoas com menos de 70 anos ocorrem em países de baixa e média renda.2
Fatores de risco e histórico do paciente
Um histórico detalhado do paciente é a primeira ferramenta para distinguir entre asma e DPOC, começando pelo estabelecimento da natureza e padrões dos sintomas respiratórios. Enquanto sintomas variáveis podem indicar asma, sintomas persistentes podem indicar DPOC.1,2 O conhecimento de um diagnóstico de asma, seja um diagnóstico na infância ou atual, ou um histórico familiar de asma ou DPOC também pode ser útil. Questionamentos detalhados também podem revelar um histórico de tabagismo ou outras exposições que indiquem um possível diagnóstico de DPOC. Por fim, um entendimento geral da exposição do paciente a fatores de risco, histórico médico e comorbidades atuais, padrão de desenvolvimento de sintomas e histórico de exacerbações ou hospitalizações anteriores pode estabelecer um entendimento diagnóstico mais completo. Asma e DPOC têm perfis de risco em grande parte diferentes, embora possa também existir alguma sobreposição. Os riscos para asma incluem doenças na infância, alergias, rinite e obesidade. Os riscos para DPOC incluem envelhecimento, tabagismo, má nutrição e fibrose, neoplasias e enfisema pulmonar. Padrões genéticos, exposição ao fumo do cigarro e exposição ocupacional são riscos comuns a ambas as condições.1,2

Limitação do fluxo de ar e dispneia
A espirometria mede o volume expiratório forçado em 1 segundo (VEF1), que representa o volume de ar exalado no primeiro segundo durante a manobra de capacidade vital forçada (CVF), sendo considerada uma das variáveis mais úteis clinicamente; e a CVF, que é o volume de gás exalado dos pulmões completamente inflados durante um esforço expiratório máximo. Durante um teste de broncodilatação, as avaliações de espirometria são realizadas após o paciente inalar um broncodilatador de curta ação. A melhora no VEF1 e/ou na CVF após o uso do broncodilatador pode sugerir asma; enquanto uma melhora limitada pode indicar DPOC.1,2

Inflamação tipo 2 na Asma e DPOC
A asma e a DPOC compartilham uma via inflamatória comum, a inflamação tipo 2, que está presente em alguns pacientes e pode causar limitação do fluxo de ar. A inflamação tipo 2 pode conduzir a doença em até 88% dos pacientes com asma grave e até ~40% dos pacientes com DPOC.10-15
Os desencadeadores da inflamação na DPOC e na asma incluem fumaça de tabaco, poluição do ar, fumaças químicas e alérgenos como pólen, mofo ou ácaros. A inflamação localizada desses desencadeadores pode contribuir para a inflamação sistêmica, resultando na produção generalizada de anticorpos de imunoglobulina E (IgE) e eosinófilos sanguíneos elevados (EOS). A inflamação tipo 2 é caracterizada pelo aumento na produção de IgE, eosinófilos elevados e níveis altos de biomarcadores, como a fração exalada de óxido nítrico (FeNO).1,2
Inflamação tipo 2 na asma grave e DPOC: principais pontos de comunicação
A inflamação tipo 2 é impulsionada pela imunidade adaptativa e inata e orquestrada por citocinas do tipo 2 (IL-4, IL-13 e IL-5).1
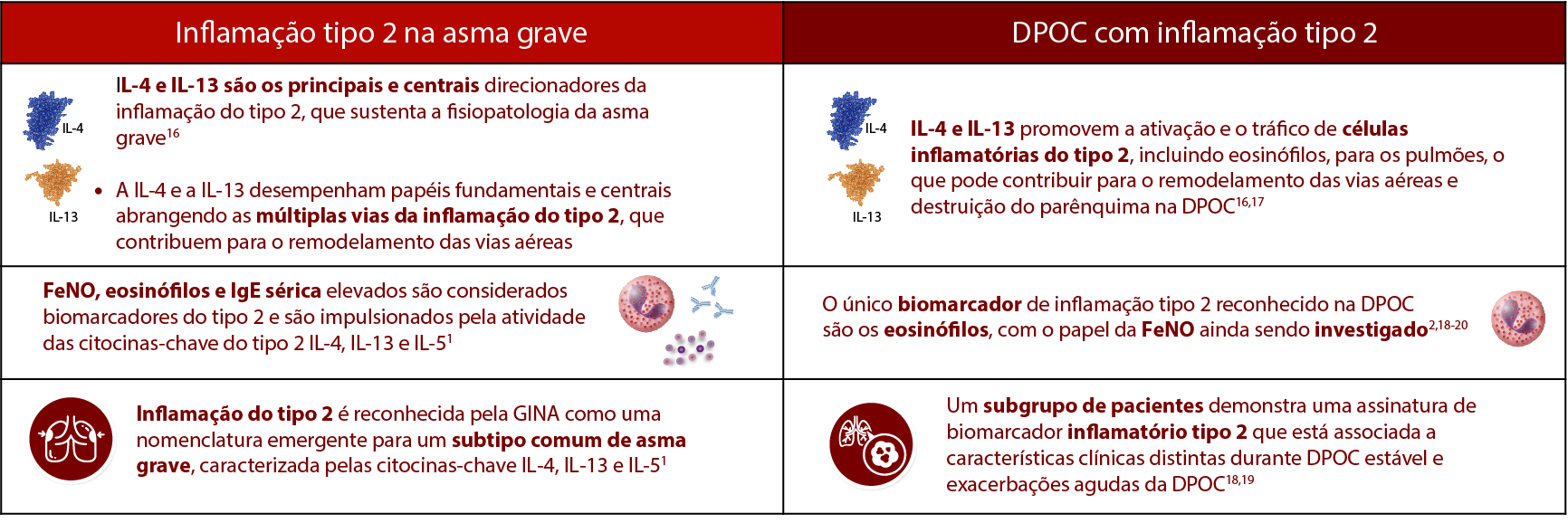
Células inflamatórias e citocinas do tipo 2 guiam a asma grave e DPOC com inflamação tipo 2, mas com diferenças importantes no recrutamento do fenótipo de eosinófilos

Conclusão
- A asma e a DPOC são doenças crônicas que obstruem as vias aéreas inferiores e prejudicam a respiração.1,2
- A asma e a DPOC compartilham alguns sintomas, sinais, comorbidades e fatores de risco.1,2
- As duas doenças não são mutuamente exclusivas e podem ocorrer simultaneamente, embora a incidência de sobreposição seja baixa.6
- Características clínicas únicas da asma incluem obstrução variável das vias aéreas, sintomas diários variáveis, início em idade precoce e a presença de alergia, rinite ou eczema.1
- A DPOC geralmente envolve progressão mais lenta dos sintomas, idade mais avançada de início e histórico de tabagismo ou outros fatores de risco.2
- Imagens, medidas funcionais e biomarcadores também podem ajudar a diferenciar as doenças.15
- Em alguns pacientes, a asma e a DPOC compartilham uma via inflamatória tipo 2 comum, caracterizada por produção aumentada de IgE, EOS elevados e FeNO elevado.10,12
- A inflamação local na asma e na DPOC pode contribuir para a inflamação sistêmica tipo 2.3,4
- As citocinas tipo 2 IL-4, IL-5 e IL-13 desempenham um papel único e central na inflamação tipo 2.16,22
- Global Initiative for Asthma.
Global Strategy for Asthma Management and Prevention, 2023.
Last updated May 2023. Accessed November 29, 2023. https://ginasthma.org/wp-content/ uploads/2023/05/GINA-2023-Full-Report-2023-WMS.pdf. - Global Initiative for Chronic Obstructive Lung Disease.
Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (2024 report).
Acessado em: 27 de março de 2024. Disponível em: https://goldcopd.org/wp-content/uploads/2024/02/GOLD-2024_v1.2-11Jan24_WMV.pdf. - Higham, A., Beech, A., Wolosianka, S., et al.
Type 2 inflammation in eosinophilic chronic obstructive pulmonary disease.
Allergy. 2021;76(6):1861-1864. - Busse, W.W., Kraft, M., Rabe, K.F., et al.
Understanding the key issues in the treatment of uncontrolled persistent asthma with type 2 inflammation.
Eur Respir J. 2021;58(2):2003393. - Adeloye, D., Song, P., Zhu, Y., et al.
Global, regional, and national prevalence of, and risk factors for, chronic obstructive pulmonary disease (COPD) in 2019: a systematic review and modelling analysis.
Lancet Respir Med. 2022;10(5):447-458. - Hosseini, M., Almasi-Hashiani, A., Sepidarkish, M., Maroufizadeh, S.
Global prevalence of asthmaCOPD overlap (ACO) in the general population: a systematic review and meta-analysis.
Respir Res. 2019;20(1):229. Published 2019 Oct 23. - Scelo, G., Torres-Duque, C.A., Maspero, J., et al.
Analysis of comorbidities and multimorbidity in adult patients in the International Severe Asthma Registry.
Ann Allergy Asthma Immunol. 2024;132(1):42-53. - Sinyor, B., Concepcion Perez, L.
Pathophysiology of asthma.
StatPearls. June 24, 2023. https://www.ncbi.nlm.nih.gov/books/NBK551579. - Wang, Z., Li, Y., Gao, Y., et al.
Global, regional, and national burden of asthma and its attributable risk factors from 1990 to 2019: a systematic analysis for the Global Burden of Disease Study 2019.
Respir Res. 2023;24(1):169. Published 2023 Jun 23. - Maspero, J., Adir, Y., Al-Ahmad, M., et al.
Type 2 inflammation in asthma and other airway diseases.
ERJ Open Res. 2022 Aug 1;8(3):00576-2021. - David, B., Bafadhel, M., Koenderman, L., De Soyza, A.
Eosinophilic inflammation in COPD: from an inflammatory marker to a treatable trait.
Thorax. 2021 Feb;76(2):188-195. - George, L., Brightling, C.E.
Eosinophilic airway inflammation: role in asthma and chronic obstructive pulmonary disease.
Ther Adv Chronic Dis. 2016 Jan;7(1):34-51. - Rabe, K.F., Rennard, S., Martinez, F.J., Celli, B.R., et al.
Targeting Type 2 Inflammation and Epithelial Alarmins in Chronic Obstructive Pulmonary Disease: A Biologics Outlook.
Am J Respir Crit Care Med. 2023 Aug 15;208(4):395-405. - Harada, N., Makita, N., Fukui, K., Nishida, K., Oneda, K., Tashiro, N.
A Retrospective Claims Database Study to Clarify Disease Burden of Severe Asthma Patients with Type 2 High or Low Inflammation.
J Asthma Allergy. 2023 Jan 5;16:83-93. - Buhl, R., Korn, S., Menzies-Gow, A., Aubier, M., et al.
Prospective, Single-Arm, Longitudinal Study of Biomarkers in Real-World Patients with Severe Asthma.
J Allergy Clin Immunol Pract. 2020 Sep;8(8):2630-2639.e6. - Gandhi, N.A., Pirozzi, G., Graham, N.M.H.
Commonality of the IL-4/IL-13 pathway in atopic diseases.
Expert Rev Clin Immunol. 2017 May;13(5):425-437. - Gandhi, N.A., Bennett, B.L., Graham, N.M., et al.
Targeting key proximal drivers of type 2 inflammation in disease.
Nat Rev Drug Discov. 2016 Jan;15(1):35-50. - Vincken, S., Sylvia, V., Daniel, S., Thomas, E., Eef, V.
The role of FeNO in stable COPD patients with eosinophilic airway inflammation.
Respir Med. 2021 May;181:106377. - Alcázar-Navarrete, B., Romero-Palacios, P.J., Ruiz-Sancho, A., Ruiz-Rodriguez, O.
Diagnostic performance of the measurement of nitric oxide in exhaled air in the diagnosis of COPD phenotypes.
Nitric Oxide. 2016 Apr 1;54:67-72. - Jamieson, D.B., et al.
Am J Respir Crit Care Med.
2013;188:187–192. - Barnes, P.J.
The cytokine network in asthma and chronic obstructive pulmonary disease.
J Clin Invest. 2008 Nov;118(11):3546-56. - Junttila, I.S.
Tuning the Cytokine Responses: An Update on Interleukin (IL)-4 and IL-13 Receptor Complexes.
Front Immunol. 2018 Jun 7;9:888. - Cabrera López, C., Sánchez Santos, A., Lemes Castellano, A., et al.
Eosinophil Subtypes in Adults with Asthma and Adults with Chronic Obstructive Pulmonary Disease.
Am J Respir Crit Care Med. 2023 Jul 15;208(2):155-162. - Freeman, C.M., et al.
Am J Respir Crit Care Med.
2023;208:121–123. - Mesnil, C., Raulier, S., Paulissen, G., et al.
Lung-resident eosinophils represent a distinct regulatory eosinophil subset.
J Clin Invest. 2016 Sep 1;126(9):3279-95.
Referências:

 nas abas abaixo. A aba em destaque mostrará o conteúdo correspondente a cada título:
nas abas abaixo. A aba em destaque mostrará o conteúdo correspondente a cada título:
 Baixa função pulmonar/limitação do fluxo de ar
Baixa função pulmonar/limitação do fluxo de ar